Grupa Badawcza Immunoterapii

W Grupie Badawczej Immunoterapii zajmujemy się rozwojem terapii przeciwnowotworowych w oparciu o układ odpornościowy. Koncentrujemy się na metodach stymulowania, modyfikowania i wzmacniania odpowiedzi immunologicznej, prowadzącej do niszczenia komórek nowotworowych. Naszym celem jest również identyfikacja nowych celów terapeutycznych oraz opracowywanie nowatorskich technologii, które mogą zwiększyć skuteczność i bezpieczeństwo immunoterapii. Metodologicznie jesteśmy zainteresowani wizualizacją dynamiki komórek odpornościowych w tkankach, zwłaszcza w mikrośrodowisku nowotworów, do czego wykorzystujemy mikroskopię przyżyciową (konfokalną i dwufotonową) oraz narzędzia analizy obrazu, uwzględniające sztuczną inteligencję.
Niewystarczająca skuteczność konwencjonalnych terapii onkologicznych doprowadziła do rozwoju nowego podejścia terapeutycznego, opartego na potencjale układu immunologicznego do niszczenia komórek zmienionych chorobowo. Immunoterapia wykorzystuje różne strategie mobilizacji komórek odpornościowych lub ich bezpośrednie podanie w celu ograniczenia wzrostu nowotworów. Postęp w dziedzinie inżynierii genetycznej umożliwił produkcję zmodyfikowanych komórek odpornościowych o aktywności cytotoksycznej wobec określonego typu nowotworu, ale tylko w układzie syngenicznym (komórki – limfocyty T – są izolowane od pacjenta, modyfikowane i namnażane w warunkach in vitro a następnie podawane terapeutycznie temu samemu pacjentowi). Jak dotąd zostało zatwierdzonych do leczenia ograniczonej liczby nowotworów krwiopochodnych (głównie białaczek) sześć terapii wykorzystujących komórki T (tzw. CAR-T), do których wprowadzono chimeryczny receptor antygenowy (ang. chimeric antigen receptor, CAR), odpowiadający za wiązanie ściśle określonego markera/antygenu nowotworowego na powierzchni komórek nowotworowych i aktywację limfocytu, prowadzącą do śmierci rozpoznanej przez ten limfocyt komórki. Dalsze ulepszenia immunoterapii komórkowych obejmują m.in. identyfikację lepszych komórek efektorowych, które mogłyby być podane pacjentowi, ale ich źródłem byliby zdrowi, niespokrewnieni dawcy (tzw. transfer allogeniczny). Jednym z obiecujących kandydatów są limfocyty T wykazujące ekspresję receptora komórek T (ang. T cell receptor, TCR) z łańcuchami γ i δ.
Limfocyty T γδ, stanowiące od 1% do 10% populacji limfocytów T krążących we krwi, posiadają właściwości zarówno wrodzonej, jak i nabytej odpowiedzi immunologicznej, co czyni je potencjalnie lepszymi kandydatami do terapii komórkowej w porównaniu z przeważającymi liczbowo limfocytami T αβ, wykorzystywanymi do produkcji komórek CAR-T. Zarówno αβ, jak i γδ TCR to główne receptory limfocytów T, które odpowiadają za ich funkcje efektorowe uruchamiane po związaniu swoistych dla siebie ligandów na zmienionych chorobowo komórkach. Receptor γδ TCR wiąże się bezpośrednio do tzw. antygenów stresu komórkowego, podczas gdy αβ TCR wymaga wstępnego przetworzenia i prezentacji antygenu za pomocą cząsteczek głównego układu zgodności tkankowej (ang. major histocompatibility complex, MHC), co pozwala limfocytom T γδ działać szybciej niż limfocytom T αβ. Istotne jest również to, że brak wrażliwości komórek T γδ na obecność cząsteczek MHC, których rodzaj jest osobniczo zmienny, pozwala na allogeniczny transfer do niespokrewnionych biorców z minimalnym ryzykiem komplikacji w postaci choroby przeszczep przeciwko gospodarzowi, często spotykanej przy podaniu limfocytów T αβ osobom niezgodnym pod względem MHC. Dodatkowo, po aktywacji limfocyty T γδ wydzielają interferon gamma (IFN-γ) i czynnik martwicy nowotworu alfa (TNF-α), które są białkami z grupy cytokin o działaniu przeciwnowotworowym. Biologia limfocytów T γδ pozostaje jednak wciąż w dużej mierze niezbadana, co opóźnia ich zastosowanie kliniczne. Identyfikacja czynników (ligandów) rozpoznawanych przez receptor γδ TCR i mechanizmów ich wiązania przez ten receptor oraz aktywacji komórek, jest obecnie przedmiotem intensywnych badań. Do tej pory wykazano, że limfocyty T γδ z łańcuchem δ typu Vδ2 (Vδ2+), obecnym w większości limfocytów T γδ krążących we krwi, reagują na fosfo-antygeny, które są niepeptydowymi i fosforylowanymi związkami związanymi z szlakami biosyntezy izoprenoidów. Inna duża subpopulacja limfocytów T γδ z łańcuchem δ typu Vδ1 (Vδ1+), występująca głównie w skórze i błonach śluzowych, rozpoznaje cząsteczki prezentowane na komórkach poddanych stresowi i transformacji nowotworowej (np. białka MICA/B i UL16BP). Co więcej, obie populacje limfocytów T γδ wykazują ekspresję białka NKG2D, które również łączy się z antygenami stresu komórkowego i może skutecznie aktywować funkcje cytotoksyczne limfocytów T γδ. Wiele danych przedklinicznych uzyskanych na myszach laboratoryjnych wykazało skuteczność limfocytów T γδ pochodzących z krwi w walce z różnymi nowotworami, co umożliwiło ich dalsze testowanie w trwających obecnie wczesnych fazach badań klinicznych.
Najważniejsze cechy komórek T γδ: 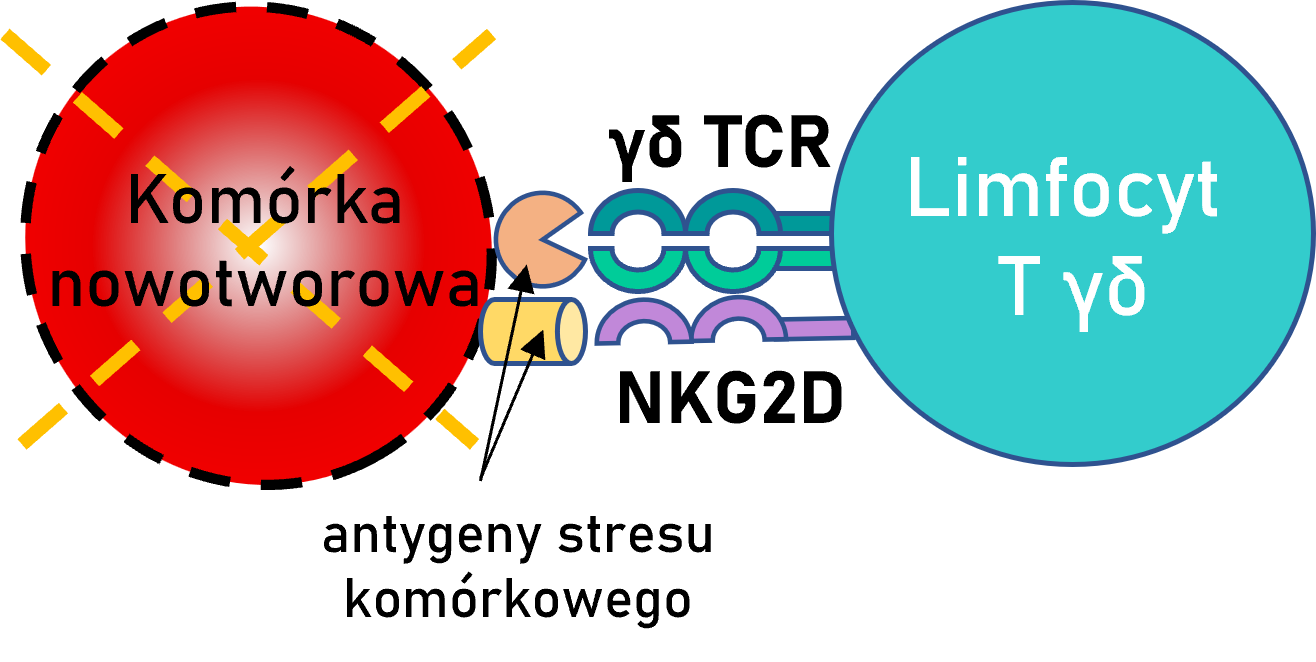
- funkcje cytotoksyczne na drodze aktywacji γδ TCR i NKG2D po rozpoznaniu antygenów stresu komórkowego
- słabo poznane ligandy γδ TCR (w przeciwieństwie do ligandów NKG2D)
- szybka odpowiedź bez przetwarzania i prezentacji antygenu (w przeciwieństwie do limfocytów T αβ)
- potencjał do transferu allogenicznego z powodu braku wrażliwości na cząsteczki MHC (w przeciwieństwie do komórek NK)
Pomimo identyfikacji niektórych ligandów γδ TCR, nadal nie jest do końca jasne, w jaki sposób limfocyty T γδ ulegają aktywacji i które cząsteczki oprócz γδ TCR są ważne. Poprzez nasze badania chcemy więc wyjaśnić te kluczowe aspekty biologii limfocytów T γδ a w dalszej perspektywie opracować technologie tworzenia bardziej skutecznych cytotoksycznych komórek efektorowych. Obejmuje to również modyfikację genetyczną limfocytów T γδ w celu poprawy ich funkcji. Naszym ostatecznym celem jest doprowadzenie do powstania produktu opartego na limfocytach T γδ i pomoc pacjentom chorym na nowotwory.
Proces badawczy: 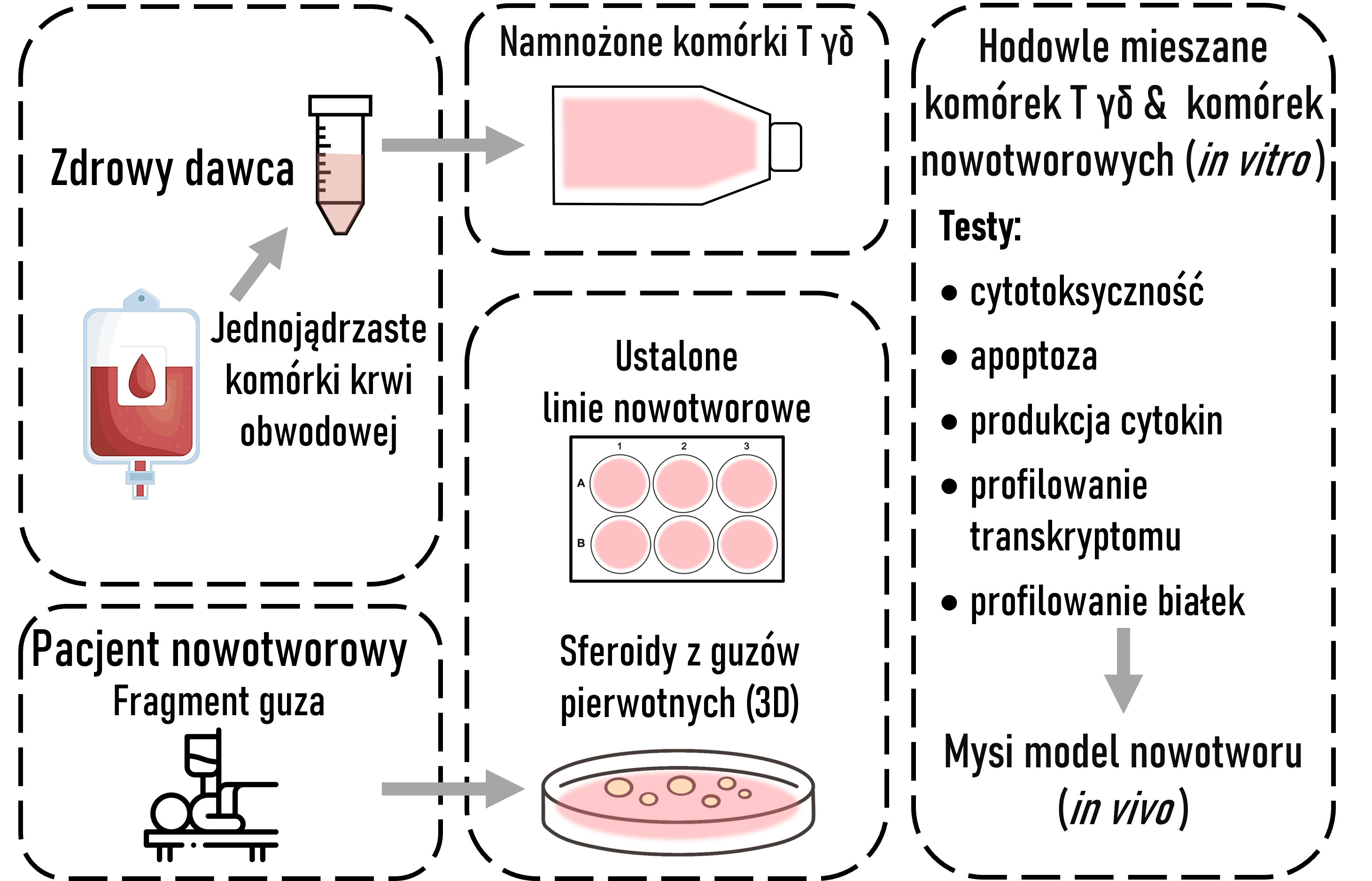
Stosując hodowle in vitro limfocytów T γδ, pochodzących z krwi, oceniamy ich funkcje cytotoksyczne wobec ustalonych linii nowotworowych i pierwotnych komórek nowotworowych pochodzących od pacjentów, w celu określenia, który typ limfocytów (Vδ2+ lub Vδ1+) wykazuje większą aktywność przeciwnowotworową i bardziej nadaje się do immunoterapii. Wykorzystujemy do tego trójwymiarowe hodowle komórek nowotworowych, które lepiej odzwierciedlają sytuację kliniczną. W następnym etapie, wyniki badań in vitro planujemy weryfikować in vivo w modelu mysim.

Dr hab. Grzegorz Chodaczek, lider grupy
Grzegorz jest absolwentem Wrocławskiego Uniwersytetu Medycznego, gdzie studiował na Wydziale Farmaceutycznym. W 2007 roku uzyskał stopień doktora nauk biologicznych w Instytucie Immunologii i Terapii Doświadczalnej PAN we Wrocławiu na podstawie badań nad właściwościami adiuwantowymi laktoferyny w preparatach szczepionkowych. W latach 2005-2007 pracował jako pracownik naukowy w University of Texas Medical Branch w Galveston w USA w laboratorium dr. Istvana Boldogha, badając rolę reaktywnych form tlenu w reakcjach alergicznych. W 2007 roku rozpoczął staż podoktorski na University of Texas MD Anderson Cancer Center w Houston w USA, w laboratorium dr. Tomasza Zala. Jego projekt obejmował mikroskopową wizualizację aktywności układu immunologicznego skóry i mikrośrodowiska nowotworu płuc. W 2011 roku objął łączone stanowisko kierownika usługowej pracowni mikroskopowej w La Jolla Institute for Immunology w San Diego, USA oraz instruktora w laboratorium dr. Mathiasa von Heratha, gdzie prowadził badania obrazowe nad udziałem układu odpornościowego w przebiegu wielu chorób (cukrzyca typu 1, infekcje wirusowe, choroba Leśniowskiego-Crohna, miażdżyca i nowotwory). W 2014 roku dołączył do Wrocławskiego Centrum Badań EIT+ (obecnie Łukasiewicz-PORT), aby pomóc w tworzeniu laboratorium zajmującego się bioobrazowaniem. W 2023 roku założył własną grupę badawczą zajmującą się immunoterapią nowotworów. Jego celem jest opracowanie innowacyjnych technologii, które mogą zwiększyć skuteczność immunoterapii.

Inż. Natalia Frankiewicz, lab manager
Natalia ukończyła studia inżynierskie na kierunku biotechnologia na Politechnice Wrocławskiej. Doświadczenie zdobywała pracując w laboratorium analitycznym, pogłębiając swoją wiedzę z zakresu wdrożeń i zarządzania jakością. W naszej grupie pełni funkcję lab managera, oferując wsparcie członkom grupy w codziennych zadaniach. Do jej obowiązków należy monitorowanie stanu magazynowego laboratorium oraz koordynacja zamówień. Odpowiada także za kontrolę budżetu i dokumentację. Wspiera grupę w zakresie technik histologicznych i immunohistochemicznych. Zajmuje się współpracą z patologami, przetwarzaniem próbek ludzkich i przygotowywaniem mikroskopowych preparatów histopatologicznych wykorzystywanych w diagnostyce.

Dr Justyna Mączyńska, inżynier badań
Justyna jest absolwentką biotechnologii na Politechnice Wrocławskiej, a stopień doktora uzyskała w Katedrze Biochemii Medycznej Wrocławskiego Uniwersytetu Medycznego. W trakcie studiów doktoranckich otrzymała grant Preludium oraz w ramach programu Erasmus+ i stypendium Etiuda zdobyła bogate doświadczenie badawcze w Zespole Przedklinicznego Obrazowania Molekularnego Instytutu Badań nad Rakiem w Londynie, gdzie odbywała także wstępny staż podoktorski . Jej głównym celem było opracowanie fotoimmunoterapii przeciwnowotworowej, wykorzystującej światło bliskiej podczerwieni i małe koniugaty fotoaktywne do detekcji i leczenia komórek złośliwych. Badała także mechanizmy leżące u podstaw transformacji immunosupresyjnego mikrośrodowiska nowotworu w mikrośrodowisko wrażliwe na aktywność układu odpornościowego. Obecnie, jako członek naszego zespołu, zajmuje się immunoterapeutycznymi podejściami do leczenia glejaka wielopostaciowego, w szczególności wykorzystując komórki T γδ w ramach adoptywnej terapii komórkowej, a jej celem jest uzyskanie głębszego wglądu w mechanizmy regulujące interakcje komórkowe w skomplikowanym mikrośrodowisku guza.

Dr Agnieszka Chwastek, inżynier badań
Agnieszka uzyskała tytuł licencjata i magistra (odpowiednio z biologii i neurobiologii) na Uniwersytecie Jagiellońskim w Krakowie, a stopień doktora z biologii medycznej otrzymała w Instytucie Farmakologii PAN w Krakowie. Jej badania skupiają się na badaniu wzajemnych powiązań w obrębie neuroimmunologicznej sieci komórkowej. Tematem tym zajmowała się już wcześniej w kontekście chorób neurodegeneracyjnych i zwierzęcych modeli bólu neuropatycznego. W naszym zespole Agnieszka pracuje nad modyfikacją genetyczną limfocytów T γδ i optymalizacją modelu humanizowanych myszy do badań terapii ludzkiego glejaka wielopostaciowego.

Mgr Agnieszka Szyposzyńska, inżynier procesu
Agnieszka ukończyła Uniwersytet Jagielloński, gdzie studiowała biotechnologię molekularną. W ramach pracy magisterskiej oceniała wpływ metod izolacji pęcherzyków zewnątrzkomórkowych na ich potencjał pro-angiogenny oraz brała udział w realizacji projektów związanych z biologią komórek macierzystych i pęcherzyków zewnątrzkomórkowych. Po zakończeniu studiów rozpoczęła pracę w Instytucie Immunologii i Terapii Doświadczalnej PAN w projekcie Baza Informacji Naukowych Wspierających Innowacyjne Terapię, mającego na celu digitalizację i udostępnianie informacji o mezenchymalnych komórkach macierzystych na platformie cyfrowej. Obecnie jest w trakcie kończenia doktoratu w Instytucie Immunologii i Terapii Doświadczalnej PAN, podczas którego badała wpływ mikropęcherzyków pochodzących z mezenchymalnych komórek macierzystych na aktywność biologiczną komórek linii i pierwotnych komórek raka jajnika z tkanki pooperacyjnej i płynu wysiękowego. W Grupie Immunoterapii wspiera zespół w codziennych czynnościach laboratoryjnych i hodowlach komórkowych.
Wybrane publikacje członków grupy (chronologicznie)
Szyposzynska A, Bielawska-Pohl A, Murawski M, Sozanski R, Chodaczek G, Klimczak A. Mesenchymal Stem Cell Microvesicles from Adipose Tissue: Unraveling Their Impact on Primary Ovarian Cancer Cells and Their Therapeutic Opportunities. Int. J. Mol. Sci. 2023; 24(21):15862. [link].
Skulska K, Kędzierska AE, Krzyżowska M, Chodaczek G. Age-Related Changes in Female Murine Reproductive Mucosa with respect to γδ T Cell Presence. J Immunol Res. 2023: 3072573. [link].
Mączyńska J, Raes F, Da Pieve C, Turnock S, Boult JKR, Hoebart J, Niedbala M, Robinson SP, Harrington KJ, Kaspera W, Kramer-Marek G. Triggering anti-GBM immune response with EGFR-mediated photoimmunotherapy. BMC Med. 2022;20(1):16. [link].
Kupczyk P, Simiczyjew A, Marczuk J, Dratkiewicz E, Beberok A, Rok J, Pieniazek M, Biecek P, Nevozhay D, Slowikowski B, Chodaczek G, Wrzesniok D, Nowak D, Donizy P. PARP1 as a Marker of an Aggressive Clinical Phenotype in Cutaneous Melanoma-A Clinical and an In Vitro Study. Cells 2021; 10(2):286. [link].
Chodaczek G, Pagni PP, Christoffersson G, Ratliff SS, Toporkiewicz M, Wegrzyn AS, von Herrath M. The effect of Toll-like receptor stimulation on the motility of regulatory T cells. J Autoimmun. 2021; 116:102563.[link].
Kulbacka J, Chodaczek G, Rossowska J, Szewczyk A, Saczko J, Bazylińska U. Investigating the photodynamic efficacy of chlorin e6 by millisecond pulses in metastatic melanoma cells. Bioelectrochemistry. 2020; 138:107728. [link].
Mączyńska J, Da Pieve C, Burley TA, Raes F, Shah A, Saczko J, Harrington KJ, Kramer-Marek G. Immunomodulatory activity of IR700-labelled affibody targeting HER2. Cell Death Dis. 2020; 11(10):886. [link].
Szyposzynska A, Bielawska-Pohl A, Krawczenko A, Doszyn O, Paprocka M, Klimczak A. Suppression of Ovarian Cancer Cell Growth by AT-MSC Microvesicles. Int J Mol Sci. 2020; 21(23):9143. [link].
Skulska K, Wegrzyn AS, Chelmonska-Soyta A, Chodaczek G. Impact of tissue enzymatic digestion on analysis of immune cells in mouse reproductive mucosa with a focus on γδ T cells. J Immunol Methods. 2019; 474:112665. [link].
Mikolajewicz K, Chodaczek G. Going deeper: three-dimensional study of γδ T cells in mouse reproductive tract using tissue clearing methods. Immunol Cell Biol. 2019; 97(1):104-111. [link].
Mączyńska J, Choromańska A, Kutkowska J, Kotulska M, Zalewski M, Zalewski J, Kulbacka J, Saczko J. Effect of electrochemotherapy with betulinic acid or cisplatin on regulation of heat shock proteins in metastatic human carcinoma cells in vitro. Oncol Rep. 2019; 41(6):3444-3454. [link].
Jurga AM, Rojewska E, Makuch W, Mika J. Lipopolysaccharide from Rhodobacter sphaeroides (TLR4 antagonist) attenuates hypersensitivity and modulates nociceptive factors. Pharm Biol. 2018; 56(1):275-286. [link].
Chodaczek G, Toporkiewicz M, Zal MA, Zal T. Epidermal T Cell Dendrites Serve as Conduits for Bidirectional Trafficking of Granular Cargo. Front. Immunol. 2018; 9:1430. [link].
Orlowski P, Tomaszewska E, Ranoszek-Soliwoda K, Gniadek M, Labedz O, Malewski T, Nowakowska J, Chodaczek G, Celichowski G, Grobelny J, Krzyzowska M. Tannic acid-modified silver and gold nanoparticles as novel stimulators of dendritic cells activation. Front. Immunol. 2018; 9:1115. [link].
Christoffersson G, Chodaczek G, Ratliff SS, Coppieters K, von Herrath MG. Suppression of diabetes by accumulation of non-islet-specific CD8+ effector T cells in pancreatic islets. Sci Immunol. 2018; 3(21): eaam6533. [link].
Borek A, Sokolowska-Wedzina A, Chodaczek G, Otlewski J. Generation of high-affinity, internalizing anti-FGFR2 single-chain variable antibody fragment fused with Fc for targeting gastrointestinal cancers. PLoS One 2018; 13(2):e0192194. [link].
Weżgowiec J, Kulbacka J, Saczko J, Rossowska J, Chodaczek G, Kotulska M. Biological effects in photodynamic treatment combined with electropermeabilization in wild and drug resistant breast cancer cells. Bioelectrochemistry 2018; 123:9-18. [link].
Jurga AM, Piotrowska A, Makuch W, Przewlocka B, Mika J. Blockade of P2X4 Receptors Inhibits Neuropathic Pain-Related Behavior by Preventing MMP-9 Activation and, Consequently, Pronociceptive Interleukin Release in a Rat Model. Front Pharmacol. 2017; 8:48. [link].
Jurga AM, Rojewska E, Piotrowska A, Makuch W, Pilat D, Przewlocka B, Mika J. Blockade of Toll-Like Receptors (TLR2, TLR4) Attenuates Pain and Potentiates Buprenorphine Analgesia in a Rat Neuropathic Pain Model. Neural Plast. 2016; 2016:5238730. [link].
Shaked I, Hanna RN, Shaked H, Chodaczek G, Nowyhed HN, Tweet G, Tacke R, Basat AB, Mikulski Z, Togher S, Miller J, Blatchley A, Salek-Ardakani S, Darvas M, Kaikkonen MU, Thomas GD, Lai-Wing-Sun S, Rezk A, Bar-Or A, Glass CK, Bandukwala H, Hedrick CC. Transcription factor Nr4a1 couples sympathetic and inflammatory cues in CNS-recruited macrophages to limit neuroinflammation. Nat Immunol. 2015; 16(12):1228-34. [link].
Hanna RN, Cekic C, Sag D, Tacke R, Thomas GD, Nowyhed H, Herrley E, Rasquinha N, McArdle S, Wu R, Peluso E, Metzger D, Ichinose H, Shaked I, Chodaczek G, Biswas SK, Hedrick CC. Patrolling monocytes control tumor metastasis to the lung. Science. 2015; 350(6263):985-90. [link].
Ariotti S, Beltman JB, Chodaczek G, Hoekstra ME, van Beek AE, Gomez-Eerland R, Ritsma L, van Rheenen J, Marée AF, Zal T, de Boer RJ, Haanen JB, Schumacher TN. Tissue-resident memory CD8+ T cells continuously patrol skin epithelia to quickly recognize local antigen. Proc Natl Acad Sci USA. 2012; 109(48):19739-44. [link].
Koltsova EK, Garcia Z, Chodaczek G, Landau M, McArdle S, Scott SR, von Vietinghoff S, Galkina E, Miller YI, Acton ST, Ley K. Dynamic T cell-APC interactions sustain chronic inflammation in atherosclerosis. J Clin Invest. 2012; 122(9):3114-26. [link].
Chodaczek G, Papanna V, Zal MA, Zal T. Body-barrier surveillance by epidermal γδ TCRs. Nat Immunol. 2012; 13(3):272-82. [link].
Zal T, Chodaczek G. Intravital imaging of anti-tumor immune response and the tumor microenvironment. Semin Immunopathol. 2010; 32(3):305-17. [link].
Chodaczek G, Bacsi A, Dharajiya N, Sur S, Hazra TK, Boldogh I. Ragweed pollen-mediated IgE-independent release of biogenic amines from mast cells via induction of mitochondrial dysfunction. Mol Immunol. 2009; 46(13):2505-14. [link].
Chodaczek G, Zimecki M, Lukasiewicz J, Lugowski C. A complex of lactoferrin with monophosphoryl lipid A is an efficient adjuvant of the humoral and cellular immune response in mice. Med Microbiol Immunol (Berl). 2006; 195(4):207-16. [link].
Obecnie realizowane projekty:
- Narodowe Centrum Nauki. OPUS, okres finansowania: 2020-2025; budżet: 3 374 760 PLN; Analiza skuteczności immunoterapii glejaka z wykorzystaniem limfocytów T gamma-delta. Rola: Kierownik projektu
- Narodowe Centrum Nauki. SONATA BIS, okres finansowania: 2022-2026; budżet: 3 985 000 PLN (485 040 PLN dla Łukasiewicz-PORT); Techniki spektroskopowe i mikroskopowe w nanosondowaniu, modelowaniu i rozpoznaniu interakcji pomiędzy erytrocytami i komórkami śródbłonka naczyniowego na poziomie molekularnym. Rola: Kierownik w ośrodku konsorcjanta
Zakończone projekty:
- Narodowe Centrum Nauki. SONATA BIS, okres finansowania: 2015-2021; budżet: 1 997 904 PLN; Wieloparametryczna charakterystyka kontroli homeostazy nabłonka układu rozrodczego przez komórki T gamma-delta z uwzględnieniem wysokorozdzielczej mikroskopii przyżyciowej. Rola: Kierownik projektu
- Narodowe Centrum Nauki. OPUS, okres finansowania: 2015-2019, budżet: 1 287 623 PLN; Konstytutywna autoreaktywność komórek T gamma-delta jako korzystny mechanizm kontroli bariery naskórka. Rola: Kierownik projektu
Jeśli jesteś zainteresowana/y dołączeniem do naszego zespołu, skontaktuj się z nami pod adresem: grzegorz.chodaczek@port.lukasiewicz.gov.pl
Obecnie poszukujemy doktorantki/doktoranta do projektu poświęconego modelowi raka jajnika w humanizowanych myszach (przewidywany start projektu II kwartał 2024).

